Transformation de la matière 1
Licence Sciences de la TerreParcours Sciences de la Terre, de l'Univers et de l'environnement
Description
Cet enseignement vise à donner les bases nécessaires à la compréhension du concept de réaction chimique. Seront abordés les notions d’états de la matière, de transformation chimique, de réaction chimique. L’enseignement permettra de mettre en place les concepts fondamentaux de constante d’équilibre et les prémices de la thermochimie et de la cinétique chimique en privilégiant une approche qualitative et un fort lien avec l’expérience.
- États physiques de la matière : différents états de la matière, transformation de la matière, loi des gaz parfaits/réels, diagrammes d’états
- Description et outils d’analyses de transformations chimiques : stœchiométrie, équation bilan, écriture d’une réaction chimique, notion de constante d’équilibre, activité chimique, loi de le Chatelier
- Évolution temporelle des équilibres chimiques : Vitesses de disparition d'un réactif et de formation d'un produit. Vitesse de réaction pour une transformation modélisée par une réaction chimique unique. Lois de vitesse (ordre simple). Loi empirique d'Arrhenius ; énergie d'activation.
- Notions de chimie nucléaire, radiochimie : cohésion du noyau, radioactivité naturelle/artificielle, rayonnements, décroissance radioactive, énergie nucléaire, unités et mesure
Compétences visées
Etats physiques de la matière macroscopique et leurs transformations
- Décrire la composition d’un système à l’aide des grandeurs physiques pertinentes.
- Déterminer l’état physique d’une espèce chimique pour des conditions expérimentales données de pression et température.
- Reconnaître la nature d’une transformation.
- Connaître la loi du gaz parfait et l'appliquer.
Transformations chimiques
- Recenser les constituants physico-chimiques présents dans un système.
- Ecrire une équation-bilan et définir la stœchiométrie.
- Définir l'avancement et le quotient d'une réaction chimique.
- Déterminer quantitativement la composition d'un système chimique dans un état d’avancement quelconque.
- Prévoir le sens de l’évolution spontanée d’un système chimique.
- Connaître et appliquer le principe de le Chatelier.
Cinétique
- Définir la vitesse d'une réaction chimique et la relier à la vitesse de disparition d’un réactif ou de formation d’un produit.
- Connaître les lois simple de vitesse, les concepts d'odre de réaction et de constante de vitesse.
- Identifier un état d’équilibre chimique.
- Déterminer la vitesse de réaction à différentes dates en utilisant une méthode numérique ou graphique.
- Connaître la loi empirique d'Arrhénius pour les constantes de vitesse.
- Connaître le phénomène de la décomposition radioactive de 1er ordre et l'appliquer pour la datation.
Compétences développées et évaluées au sein de l’UE/matière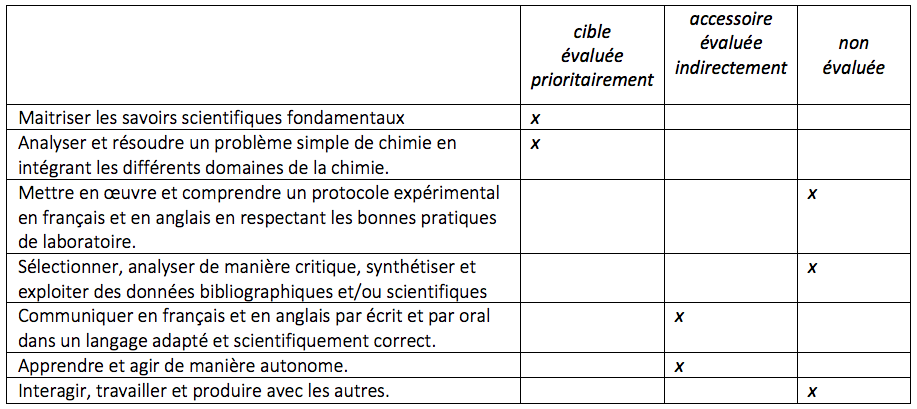
Modalités d'organisation et de suivi
Modalités d’évaluation des apprentissages : pour chaque épreuve prévue remplir le tableau ci-dessous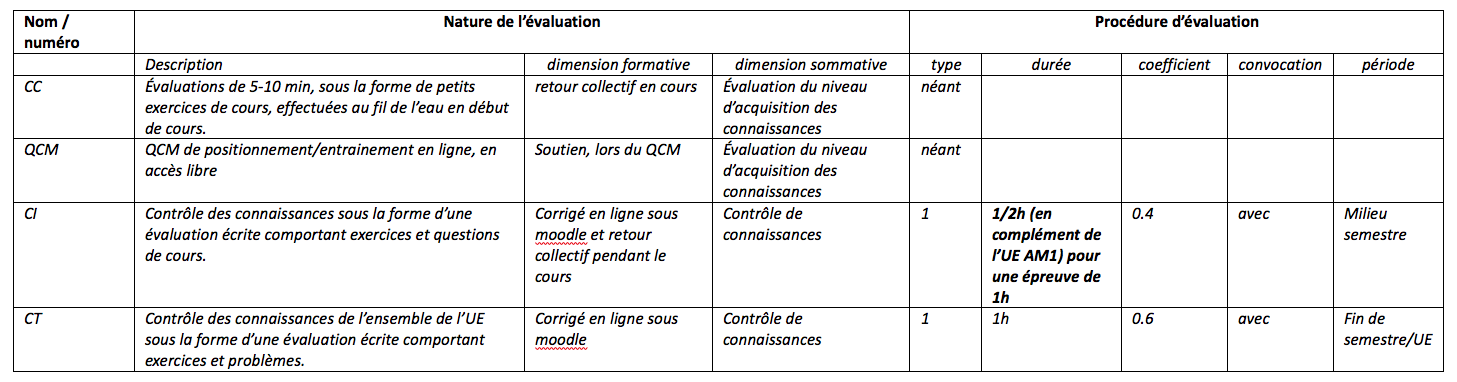
Contacts
Responsable(s) de l'enseignement
MCC
Les épreuves indiquées respectent et appliquent le règlement de votre formation, disponible dans l'onglet Documents de la description de la formation.
- Régime d'évaluation
- ECI (Évaluation continue intégrale)
- Coefficient
- 2.0
Évaluation initiale / Session principale - Épreuves
| Libellé | Type d'évaluation | Nature de l'épreuve | Durée (en minutes) | Coéfficient de l'épreuve | Note éliminatoire de l'épreuve | Note reportée en session 2 |
|---|---|---|---|---|---|---|
écrit 1 TM1 | AC | ET | 60 | 0.80 | ||
écrit 2 TM1 | AC | ET | 90 | 1.20 |
